剛剛�����!國家藥監(jiān)局發(fā)布2019年度藥品審評報告
藥通社摘取部分
一、藥品注冊申請受理情況
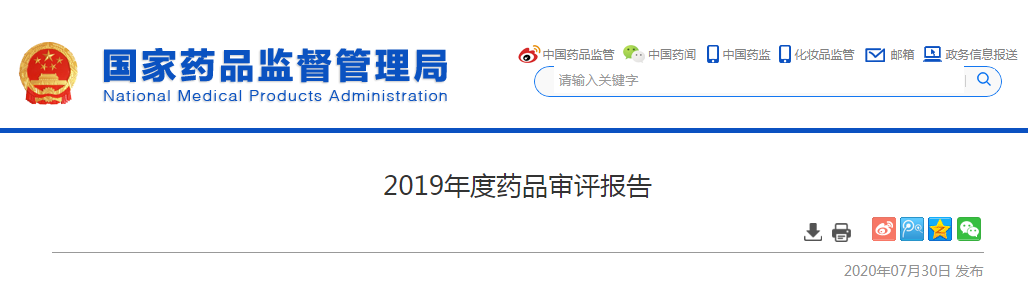
2019年����,藥審中心受理新注冊申請8082件(含器械組合產(chǎn)品5件,以受理號計����,下同),其中需技術審評的注冊申請6199件(含4907件需藥審中心技術審評和行政審批的注冊申請)��,直接行政審批(無需技術審評�����,下同)的注冊申請1878件��。
?���。ㄒ唬┛傮w情況
藥審中心受理的8077件藥品注冊申請中,化學藥注冊申請受理量為6475件��,占2019年全部注冊申請受理量的80.2%�����,2016-2019年各類藥品注冊申請受理情況詳見圖1�。
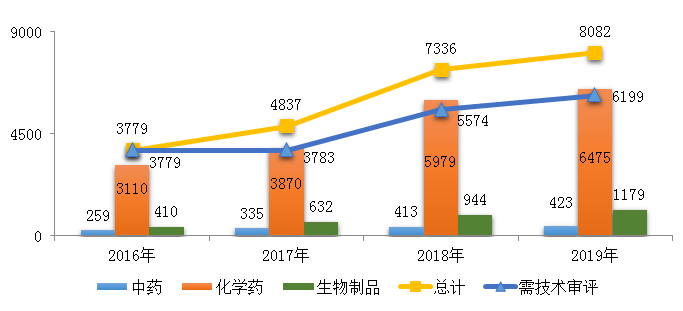
圖1 2016-2019年各類藥品注冊申請受理情況
注:1.2019年受理量中含5件器械組合產(chǎn)品的注冊申請��,故上圖中2019年受理注冊申請總量大于中藥��、化學藥���、生物制品受理注冊申請之和;2. 藥審中心的直接行政審批工作自2017年開始�,所以2016年無直接行政審批注冊申請,所有受理注冊申請均需技術審評����。
圖2 2017-2019年需技術審評的各類藥品注冊申請受理情況
2019年����,受理需技術審評的注冊申請6199件,較2018年增加11.21%,其中化學藥注冊申請為4937件���,較2018年增長了10.72%�����,占全部需技術審評的注冊申請受理量的79.64%�;中藥注冊申請257件��,較2018年降低了14.33%����;生物制品注冊申請1005件,較2018年增長了23.3%�����。2016-2019年需技術審評的化學藥�����、中藥和生物制品注冊申請受理情況詳見圖2�。
藥審中心受理1類創(chuàng)新藥注冊申請共700件(319個品種),(化學藥的品種數(shù)以活性成分統(tǒng)計�,中藥和生物制品的品種數(shù)均以藥品通用名稱統(tǒng)計,下同),品種數(shù)較2018年增長了20.8%�。其中,受理1類創(chuàng)新藥的新藥臨床試驗(IND)申請302個品種��,較2018年增長了26.4%��;受理1類創(chuàng)新藥的新藥上市申請(NDA)17個品種����,較2018年減少了8個品種����。
(二)國產(chǎn)創(chuàng)新藥受理情況
藥審中心受理國產(chǎn)1類創(chuàng)新藥注冊申請528件(244個品種)��,其中受理臨床申請503件(228個品種)���,上市申請25件(16個品種)���。按藥品類型統(tǒng)計,化學藥401件(144個品種)���,生物制品127件(100個品種)�,創(chuàng)新藥的適應癥主要集中在抗腫瘤、抗感染和消化系統(tǒng)疾病領域�����。
?����。ㄈ﹦?chuàng)新藥及原研藥受理情況
藥審中心受理5.1類化學藥原研藥注冊申請157件(92個品種)�����,受理1類創(chuàng)新藥注冊申請172件(75個品種)�,創(chuàng)新藥的適應癥主要集中在抗腫瘤、內(nèi)分泌和神經(jīng)系統(tǒng)疾病領域�����。
?���。ㄋ模└黝愖陨暾埵芾砬闆r
1.化學藥注冊申請受理情況
藥審中心受理化學藥注冊申請6475件,其中受理化學藥IND申請694件��,較2018年增長了51.9%�;受理化學藥NDA 130件��,較2018年增長了21.5%�����;受理仿制藥上市申請(ANDA)1047件���,較2018年增長了6.6%;受理一致性評價補充申請1038件(308個品種)��,件數(shù)較2018年增長71%�。2019年化學藥各類注冊申請受理情況詳見圖3��。2016-2019年化學藥IND申請����、NDA和一致性評價等注冊申請受理情況詳見圖4。
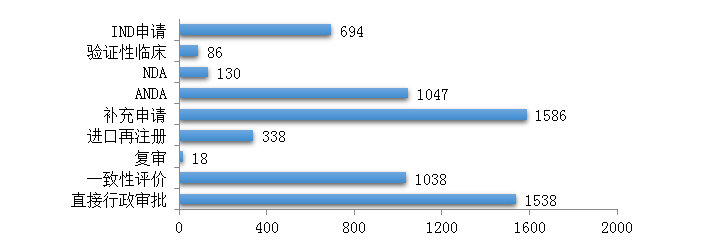
圖3 2019年化學藥各類注冊申請受理情況
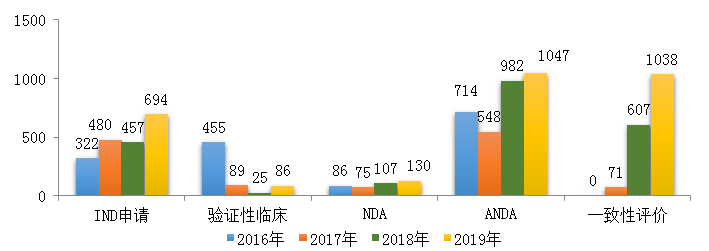
圖4 2016-2019年化學藥IND申請���、NDA和一致性評價等注冊申請受理情況
注:藥審中心自2017年8月開始承擔仿制藥質量和療效一致性評價工作
?�。?)國產(chǎn)�����、化學藥IND申請���、NDA受理情況
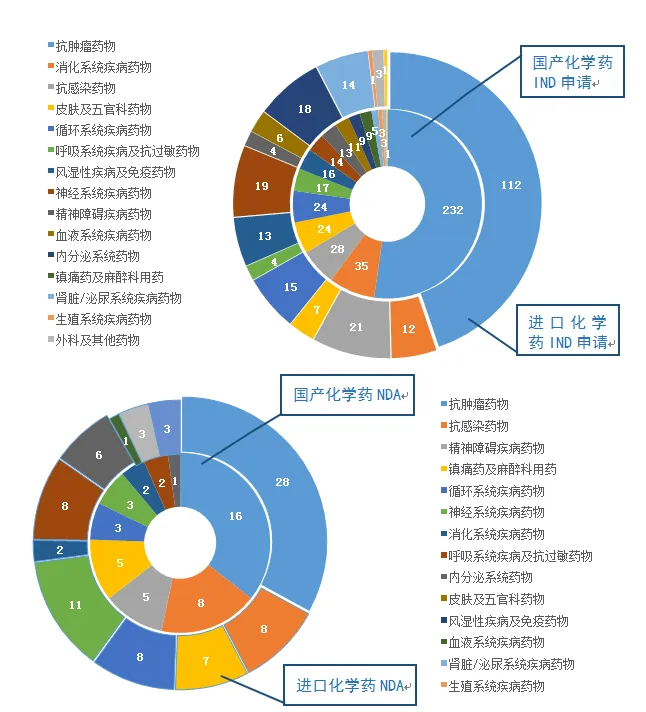
圖5 2019年受理國產(chǎn)和的化學藥IND申請����、NDA治療領域分布情況
在化學藥IND申請中�����,受理國產(chǎn)化學藥IND申請444件�����,受理IND申請250件��。國產(chǎn)化學藥IND申請的適應癥主要集中在抗腫瘤、消化系統(tǒng)和抗感染藥物領域�����,IND申請的適應癥主要集中在抗腫瘤�、抗感染藥物和神經(jīng)系統(tǒng)領域。
化學藥NDA中�,受理國產(chǎn)化學藥NDA 45件,受理化學藥NDA 85件���。國產(chǎn)化學藥NDA的適應癥主要集中在抗腫瘤和抗感染藥物領域�����,化學藥NDA的適應癥主要集中在抗腫瘤和神經(jīng)系統(tǒng)領域。2019年受理國產(chǎn)和的化學藥IND申請���、NDA治療領域分布情況詳見圖5����。
?�。?)1類化學藥創(chuàng)新藥受理情況
藥審中心受理1類化學藥創(chuàng)新藥注冊申請573件(219個品種)�����,品種數(shù)較2018年增加了39.5%,其中受理IND申請206個品種��,較2018年增長了46.1%�;受理NDA 13個品種,較2018年減少了3個�。
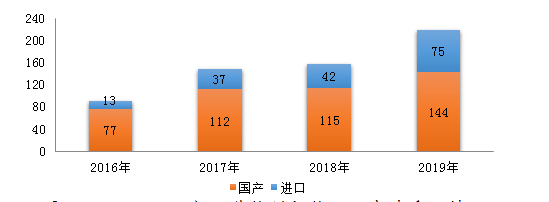
圖6 2016-2019年化學藥創(chuàng)新藥注冊申請受理情況
219個品種的1類化學藥創(chuàng)新藥注冊申請中,國產(chǎn)化學藥創(chuàng)新藥注冊申請為144個品種�����,化學藥創(chuàng)新藥注冊申請為75個品種���。2016-2019年創(chuàng)新藥注冊申請受理情況詳見圖6��。
2.中藥注冊申請受理情況
藥審中心受理中藥注冊申請423件�����,其中受理中藥IND申請17件�����,受理中藥NDA 3件�,受理中藥ANDA 3件。2019年中藥各類注冊申請受理情況詳見圖7�����。2016-2019年中藥IND申請����、NDA和ANDA受理情況詳見圖8。
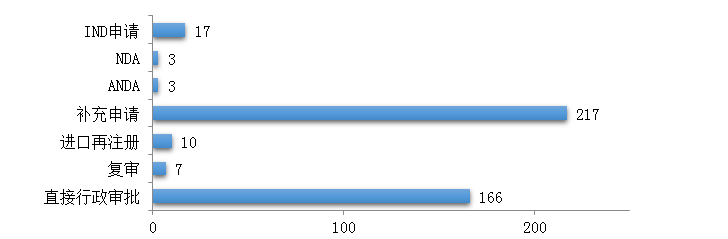
圖7 2019年中藥各類注冊申請受理情況
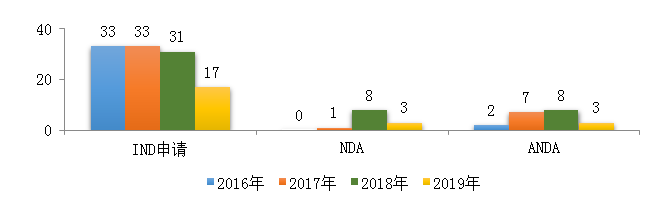
圖8 2016-2019年中藥IND申請���、NDA�����、ANDA受理情況
?���。?)中藥IND申請受理情況
在17件中藥IND申請(5、6��、8類)中�����,適應癥主要集中的治療領域為消化�����、呼吸和骨科���,占全部中藥IND申請的76%�����。
?����。?)中藥新藥受理情況
藥審中心受理5-6類中藥新藥注冊申請18件(18個品種��,無1-4類中藥注冊申請)�,其中中藥IND申請15件(15個品種),中藥NDA 3件(3個品種)�,較2018年均有所減少。
3.生物制品注冊申請受理情況
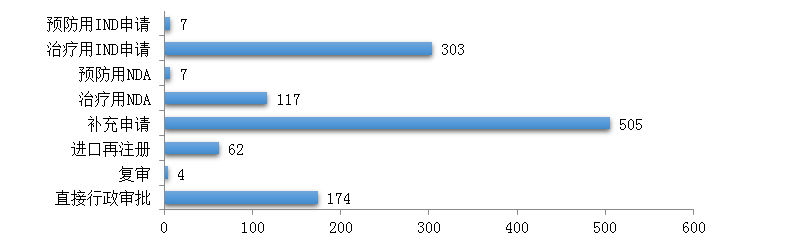
圖9 2019年生物制品各類注冊申請受理情況
藥審中心受理生物制品注冊申請1179件�,其中受理生物制品IND申請310件(預防用IND申請7件,治療用IND申請303件)����,較2018年增長了4%;受理生物制品NDA 124件(預防用NDA 7件����,治療用NDA 117件),較2018年增長了45.9%�����。2019年生物制品各類注冊申請受理情況詳見圖9�����。2016-2019年生物制品IND申請和NDA受理情況詳見圖10��。
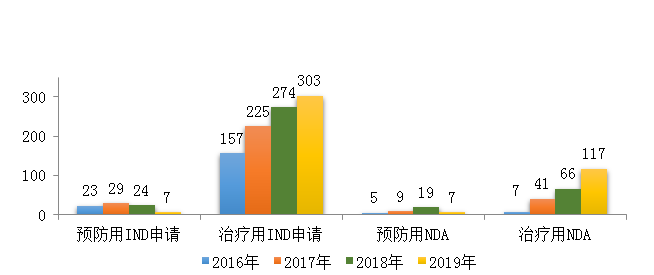
圖10 2016-2019年生物制品IND申請和NDA受理情況
?���。?)I類生物制品創(chuàng)新藥受理情況
藥審中心受理1類生物制品創(chuàng)新藥注冊申請127件(100個品種),件數(shù)較2018年增長了3.3%�,其中預防用生物制品2件,治療用生物制品125件���。1類生物制品創(chuàng)新藥注冊申請中����,IND申請121件(96個品種)�,較2018年增長了8%;NDA 6件(4個品種����,均為治療用生物制品),較2018年減少了5件���。
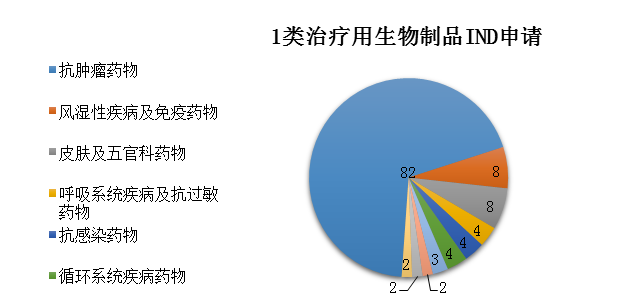
圖11 2019年受理的1類治療用生物制品IND申請治療領域分布情況
藥審中心受理1類治療用生物制品IND申請119件(95個品種)�,適應癥主要集中在抗腫瘤治療領域,占全部1類治療用生物制品IND申請的69%����,具體治療領域分布詳見圖11。
二���、藥品注冊申請審評審批情況
?���。ㄒ唬┛傮w完成情況
1.全年審評審批完成情況
2015年至2018年期間藥審中心通過擴充審評通道�、強化審評項目管理、大規(guī)模招聘人員���、借調(diào)省局人員等措施多渠道擴增審評力量��、提高審評效率�,使得藥品注冊申請積壓基本得以解決,藥審中心的工作重點已經(jīng)由解決藥品注冊申請積壓逐漸過渡為提升藥品注冊申請的按時限審評審批率���,2019年藥審中心實現(xiàn)了中藥、化學藥��、生物制品各類注冊申請按時限審評審批率超過90%�����,基本完成了國務院《關于改革藥品醫(yī)療器械審評審批制度的意見》(國發(fā)〔2015〕44號�����,以下簡稱44號文件)確定2018年實現(xiàn)按規(guī)定時限審批的工作目標�。
2019年完成審評審批的注冊申請共8730件(含器械組合產(chǎn)品5件),其中完成需技術審評的注冊申請6817件(含4075件需藥審中心技術審評和行政審批注冊申請)��,完成直接行政審批的注冊申請1908件�����。2019年底在審評審批和等待審評審批的注冊申請已由2015年9月高峰時的近22000件降至4423件(不含完成審評因申報資料缺陷等待申請人回復補充資料的注冊申請)����,鞏固了44號文件要求解決注冊申請積壓的改革成效���。
2019年4423件在審評審批和等待審評審批的注冊申請中,啟動審評3334件�,審評結束等待核查450件,處于暫停審評計時等待關聯(lián)品種(290件)�、等待申請人核對質標說明書包裝標簽工藝(235件)、等待檢驗報告(36件)等情況中的任務共639件���。
完成技術審評的6817件注冊申請中���,中藥注冊申請300件,生物制品注冊申請1104件�����,化學藥注冊申請為5413件��,化學藥注冊申請約占全部審評完成量的79%�����。
2.各類注冊申請審評完成情況
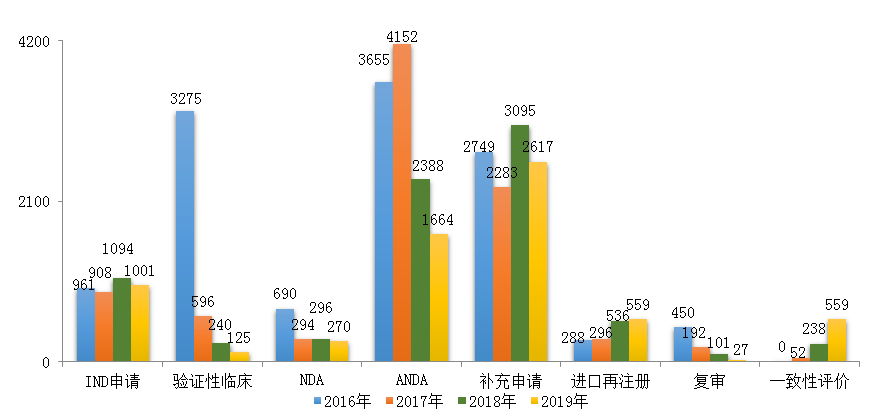
圖12 2016-2019年各類注冊申請審評完成情況
注:2019年含5件器械組合產(chǎn)品的注冊申請��,故上圖中2019年注冊申請總量大于中藥、化學藥����、生物制品注冊申請之和。
藥審中心完成IND申請審評1001件(含1件器械組合產(chǎn)品)�,完成NDA審評270件(含1件器械組合產(chǎn)品)�,完成ANDA審評1664件(含3件藥械組合產(chǎn)品)。2016-2019年各類注冊申請審評完成情況詳見圖12���。
3.審評通過情況
2019年���,藥審中心審評通過批準IND申請926件,審評通過NDA 164件���,審評通過ANDA 654件�,審評通過批準口服固體制劑一致性評價申請260件(按活性成分統(tǒng)計95個品種����,按通用名統(tǒng)計107個品種,詳見附表1)����,品種數(shù)較2018年(57個品種)同比增長66.7%���。
審評通過上市1類創(chuàng)新藥10個品種,審評通過原研藥58個品種(含新適應癥)���,具體品種詳見附表2��、3����。
?���。ǘ┗瘜W藥注冊申請審評完成情況
1.總體情況
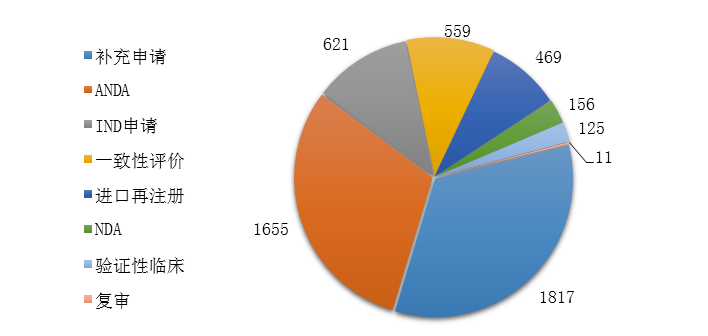
圖13 2019年化學藥各類注申請的審評完成情況
藥審中心完成審評的化學藥注冊申請5413件,其中完成化學藥臨床申請(IND申請和驗證性臨床)共746件����,完成化學藥NDA 156件,完成化學藥ANDA 1655件��。2019年化學藥各類注冊申請的審評完成情況詳見圖13���。
2.審評通過情況
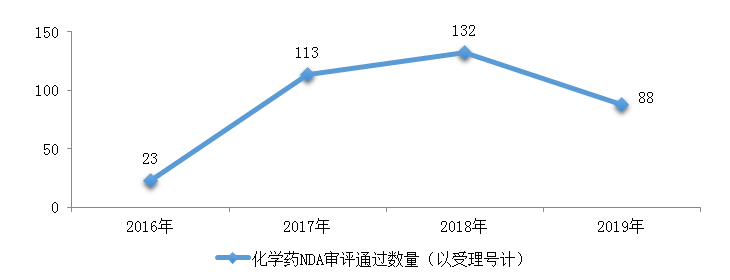 圖14 2016-2019年化學藥NDA審評通過數(shù)量情況
圖14 2016-2019年化學藥NDA審評通過數(shù)量情況
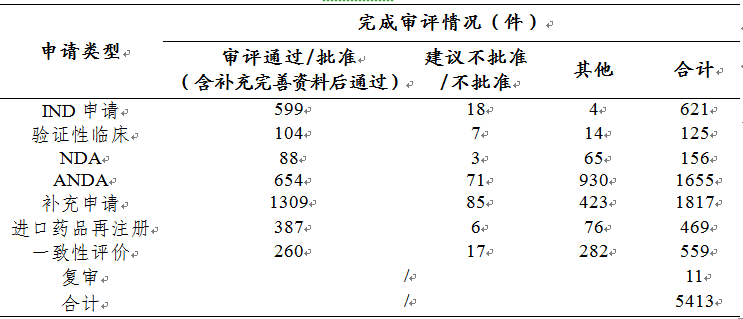
表1 2019年化學藥各類注冊申請審評完成的具體情況
 注:“其他”是指申請人主動申請撤回的注冊申請�����、完成審評等待申請人補充完善申報資料的注冊申請�、非藥審中心審評報送國家局藥品注冊管理司的注冊申請�����、送國家局醫(yī)療器械技術審評中心的藥械組合注冊申請和關聯(lián)制劑撤回的原料/輔料注冊申請等�,下同。
注:“其他”是指申請人主動申請撤回的注冊申請�����、完成審評等待申請人補充完善申報資料的注冊申請�、非藥審中心審評報送國家局藥品注冊管理司的注冊申請�����、送國家局醫(yī)療器械技術審評中心的藥械組合注冊申請和關聯(lián)制劑撤回的原料/輔料注冊申請等�,下同。
藥審中心完成審評的化學藥NDA共156件���,其中審評通過88件�����。2016-2019年化學藥NDA審評通過數(shù)量情況詳見圖14���,2019年化學藥各類注冊申請審評完成的具體情況詳見表1����。
藥審中心完成審評的化學藥IND申請621件�����,審評通過批準IND申請599件�,其中批準1類化學藥創(chuàng)新藥IND申請493件(189個品種)。2016-2019年1類化學藥創(chuàng)新藥IND申請審評通過批準數(shù)量詳見圖15���。
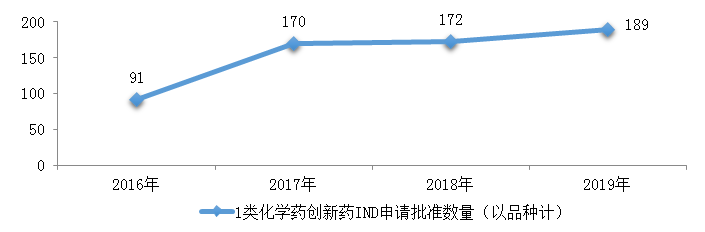
圖15 2016-2019年1類化學藥創(chuàng)新藥IND申請批準數(shù)量
藥審中心批準IND申請的189個1類化學藥創(chuàng)新藥中�����,抗腫瘤藥物����、消化系統(tǒng)疾病藥物、抗感染藥物和神經(jīng)系統(tǒng)疾病藥物較多,占全部創(chuàng)新藥臨床試驗批準數(shù)量的70%����。2019年審評審批IND申請的1類化學藥創(chuàng)新藥適應癥分布詳見圖16。
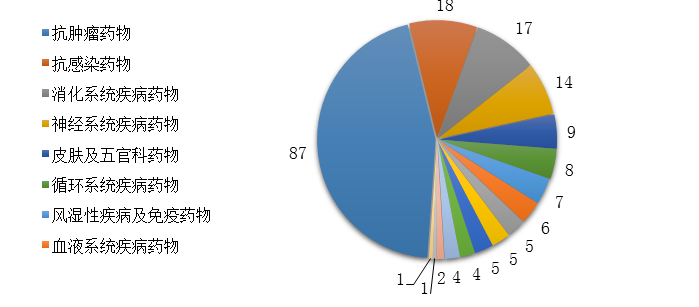 圖16 2019年審評審批IND申請的1類化學藥創(chuàng)新藥適應癥分布
圖16 2019年審評審批IND申請的1類化學藥創(chuàng)新藥適應癥分布
注:部分化學藥創(chuàng)新藥有多個適應癥分布在不同的適應癥分組中���,故上圖中各適應癥分組創(chuàng)新藥品種數(shù)之和大于189個���。
?��。ㄈ┲兴幾陨暾垖徳u完成情況
1.總體情況
藥審中心完成審評的中藥注冊申請300件���,其中完成IND申請17件,完成NDA 3件��,完成ANDA 6件�����。2019年中藥各類注冊申請的審評完成情況詳見圖17。
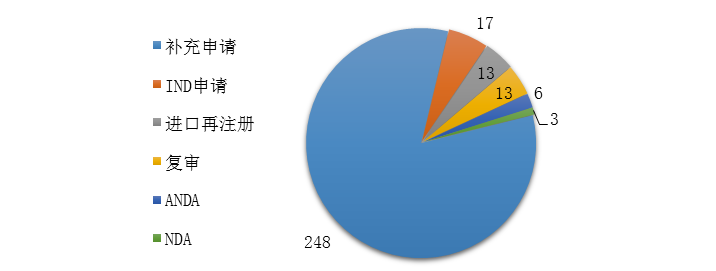
圖17 2019年中藥各類注冊申請的審評完成情況
2.審評通過情況
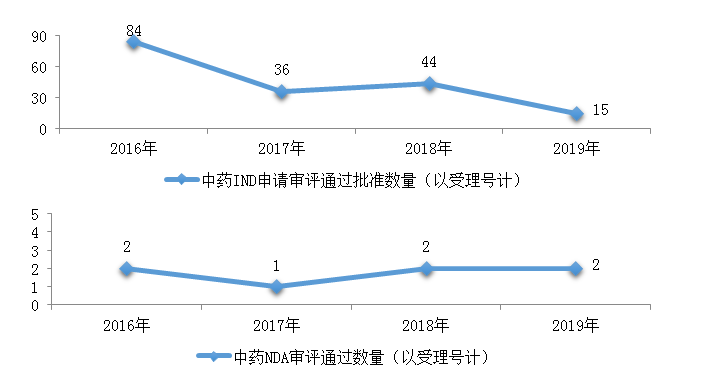
圖18 2016-2019年中藥IND申請審評通過批準和NDA審評通過數(shù)量
藥審中心審評通過批準中藥IND申請15件,審評通過中藥NDA 2件(2個品種��,芍麻止痙顆粒�����、小兒荊杏止咳顆粒)�����。2019年中藥各類注冊申請審評完成的具體情況詳見表2�����,2016-2019年中藥IND申請審評通過批準和NDA審評通過數(shù)量詳見圖18。
表2 2019年中藥各類注冊申請審評完成的具體情況

藥審中心審評通過批準的中藥IND申請15件�����,涉及10個適應癥領域�����,其中心血管�、消化��、腫瘤����、呼吸�、腎臟各2件����,共占67%��,具體治療領域分布詳見圖19���。
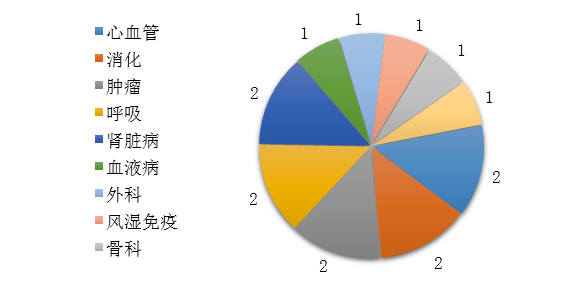
圖19 2019年批準IND申請的中藥適應癥分布
(四)生物制品注冊申請審評完成情況
1.總體情況
藥審中心完成審評的生物制品注冊申請共1104件����,其中完成預防用生物制品IND申請(預防用IND申請)24件,完成治療用生物制品IND申請(治療用IND申請)338件���,完成預防用生物制品NDA(預防用NDA)13件���,完成治療用生物制品NDA(治療用NDA)95件,完成體外診斷試劑NDA(體外診斷NDA)2件���。2019年生物制品各類注冊申請的審評完成情況詳見圖20�。
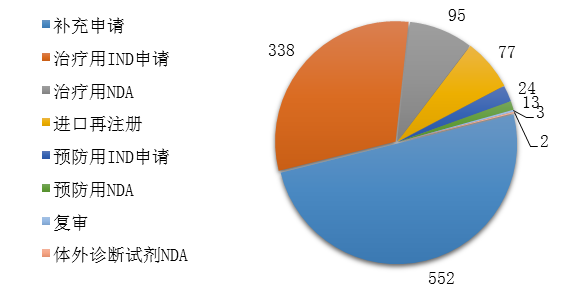
圖20 2019年生物制品各類注冊申請的審評完成情況
2.審評通過情況
藥審中心審評通過批準預防用IND申請18件、治療用IND申請294件����,審評通過預防用NDA 5件、治療用NDA 67件���、體外診斷NDA 2件����。2019年生物制品各類注冊申請審評完成的具體情況詳見表3�,2016-2019生物制品IND申請審評通過批準和NDA審評通過數(shù)量詳見圖21。
表3 2019年生物制品各類注冊申請審評完成的具體情況
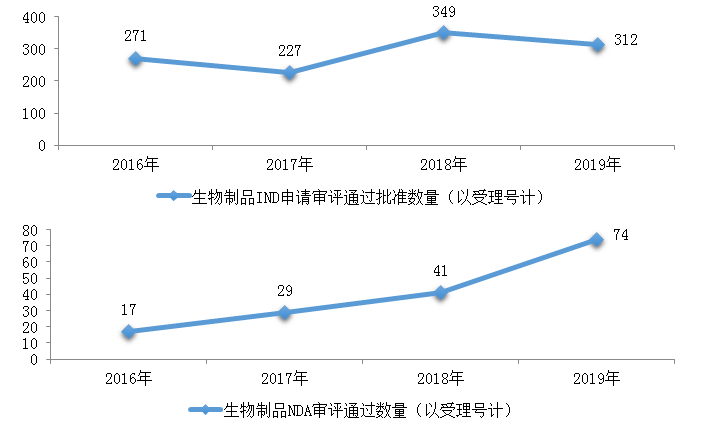
圖21 2016-2019年生物制品IND申請審評通過批準和NDA審評通過數(shù)量
藥審中心審評通過批準生物制品IND申請312件,治療領域分布詳見圖22����。
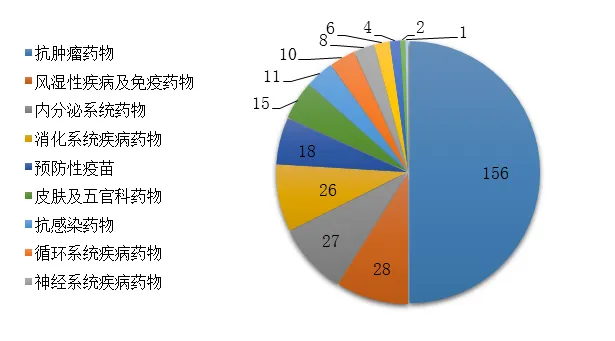
圖22 2019年批準的生物制品IND申請適應癥分布
藥審中心審評通過批準生物制品NDA 74件�����,治療領域分布詳見圖23�。
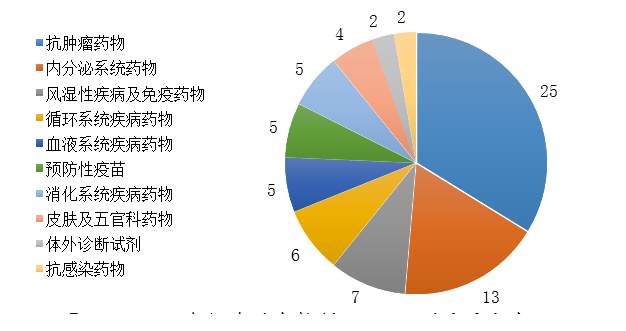
圖23 2019年批準的生物制品NDA適應癥分布
?���。ㄎ澹┬姓徟陨暾埻瓿汕闆r
1.總體情況
2019年,藥審中心完成行政審批中藥���、化學藥�����、生物制品注冊申請5983件���,其中完成審評審批的注冊申請(臨床試驗申請���、一致性評價、補充申請��、藥品再注冊申請及復審)4075件���,完成直接行政審批的注冊申請(無需技術審評的補充申請�、臨時申請)1908件�。
2.審評審批完成情況
4075件需藥審中心審評審批的注冊申請中,臨床試驗申請1124件(含驗證性臨床)����、一致性評價345件、補充申請2127件�、藥品再注冊申請471件、復審8件����。按照臨床試驗60日默示許可制度,藥審中心完成審評審批后發(fā)出臨床試驗通知書1178份����,含1066份《臨床試驗通知書》和112份《暫停臨床試驗通知書》�����。因ANDA等注冊申請在技術審評過程中需申請人補充臨床試驗,藥審中心會以《臨床試驗通知書》的形式告知申請人�,故臨床試驗通知書發(fā)出數(shù)量大于需藥審中心審評審批的臨床試驗申請1124件。
3.直接行政審批完成情況
1908件藥審中心技術審評的直接行政審批注冊申請中����,補充申請1491件、臨時申請417件�����。
1908件藥審中心直接行政審批注冊申請平均審批時限為9.9個工作日�,其中有1905件在法定的20日時限內(nèi)完成,全年平均按時限完成率為99.8%�。
(六)優(yōu)先審評情況
1.優(yōu)先審評品種納入情況
根據(jù)原國家食品藥品監(jiān)督管理總局(以下簡稱原總局)《關于解決藥品注冊申請積壓實行優(yōu)先審評審批的意見》(食藥監(jiān)藥化管〔2016〕19號)和《關于鼓勵藥品創(chuàng)新實行優(yōu)先審評審批的意見》(食藥監(jiān)藥化管〔2017〕126號)�����,2019年藥審中心將253件(按通用名計139個品種)注冊申請納入優(yōu)先審評程序���,同比降低19.2%�����,其中兒童用藥和罕見病用藥52件���。2016-2019年納入優(yōu)先審評程序的各類注冊申請情況詳見表4�。
表4 2016-2019年納入優(yōu)先審評程序的注冊申請情況
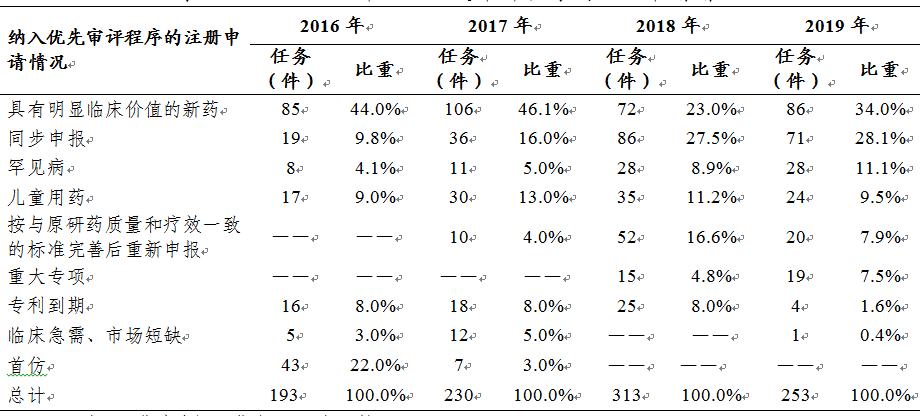
注:1.優(yōu)先審評工作自2016年開始。
2. 比重=當年各類任務/任務總量�����,下同�����。
在已納入優(yōu)先審評的注冊申請中����,具有明顯臨床價值的新藥占比34%,所占比例最大�,其次為同步申報品種(28.1%)。與2018年已納入優(yōu)先審評注冊申請的結構相比較,具有明顯臨床價值的新藥占比由23%增至34%��,按與原研藥質量和療效一致的標準完善后重新申報品種占比則由16.6%降至7.9%�����,從數(shù)據(jù)變化上來看�,仿制藥數(shù)量逐漸減少���,優(yōu)先審評資源更多的聚焦到具有明顯臨床價值����、臨床急需和臨床優(yōu)勢的藥品上來����。
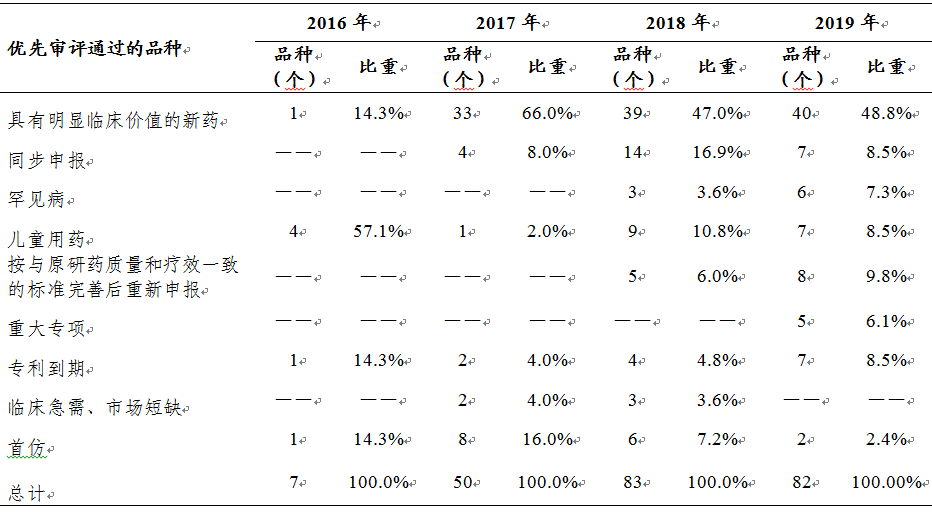
2.優(yōu)先審評品種完成情況
2019年有143件注冊申請(按通用名計82個品種)通過優(yōu)先審評程序,得以加快批準上市�����,如我國自主研發(fā)的1類創(chuàng)新藥注射用甲苯磺酸瑞馬唑侖�、甘露特鈉膠囊,治療罕見病法布雷病注射用阿加糖酶β��,新型核因子κB受體激活因子配體(RANKL)抑制劑地舒單抗注射液,治療糖尿病的聚乙二醇洛塞那肽注射液�、治療銀屑病的本維莫德乳膏、非小細胞肺癌靶向治療藥物達可替尼片等藥品����。近幾年優(yōu)先審評的品種情況詳見表5,具體品種名單詳見附表4�����。
表5 2016-2019年優(yōu)先審評通過的品種情況
?。ㄆ撸贤ń涣髑闆r
1.總體情況
為進一步強化服務意識,為申請人研發(fā)創(chuàng)新提供便捷的指導和服務����,藥審中心不斷豐富溝通交流渠道,提高溝通交流效率和質量���,形成了溝通交流會議�����、一般性技術問題咨詢��、電話咨詢��、郵件咨詢和現(xiàn)場咨詢的多渠道���、多層次的溝通交流模式��。
2019年藥審中心接收溝通交流會議申請2633件���,較2018年增長了32.8%,辦理溝通交流會議申請1871件��,較2018年增長了41.1%��。藥審中心為保證會議質量����、提高會議效率����,按照國家局《關于發(fā)布藥品研發(fā)與技術審評溝通交流管理辦法的公告》(2018年第74號)相關要求,在會前嚴格篩選���,剔除了存在重復提交和未提供有效會議資料等問題的會議申請�����,經(jīng)過審核的會議申請����,按時限要求盡快召開溝通交流會議。對于無需召開會議的申請�,藥審中心均采用書面回復的形式及時反饋申請人。
2019年在網(wǎng)絡平臺接收一般性技術問題咨詢16572個�,較2018年增長了8.9%;接收電話咨詢超過上萬次�,郵件咨詢數(shù)千件,同時也面向社會提供現(xiàn)場咨詢服務���。近幾年接收溝通交流申請和一般性技術問題咨詢具體情況詳見圖24��。
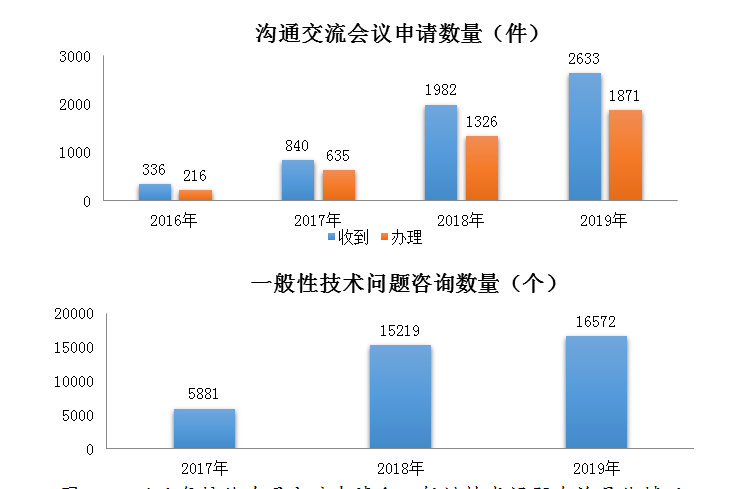
圖24 近幾年接收溝通交流申請和一般性技術問題咨詢具體情況
注:一般性技術問題的解答工作自2017年開始���。
2.溝通交流會議申請的完成情況
表6 2019年各類溝通交流會議申請及辦理情況
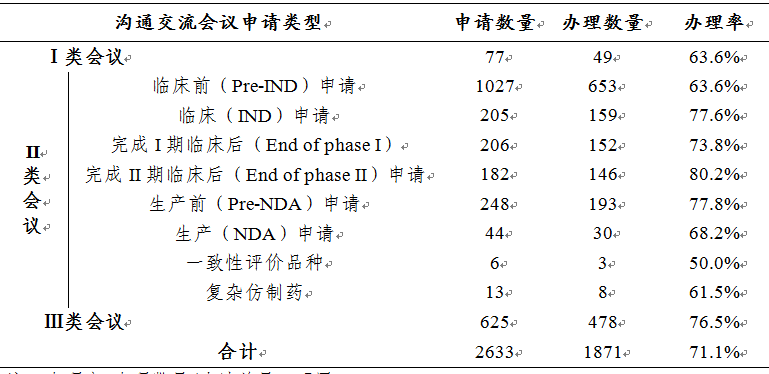
注:辦理率=辦理數(shù)量/申請總量�,下同。
在藥審中心所辦理的1871件溝通交流會議申請中�����,在藥物研發(fā)關鍵階段召開的II類會議所占比例較大���,為71.8%,而II類會議中Pre-IND會議申請占比最多�����,為34.9%���。2019年各類溝通交流會議申請及辦理情況詳見表6���。
表7 2018-2019年各類溝通交流會議召開情況
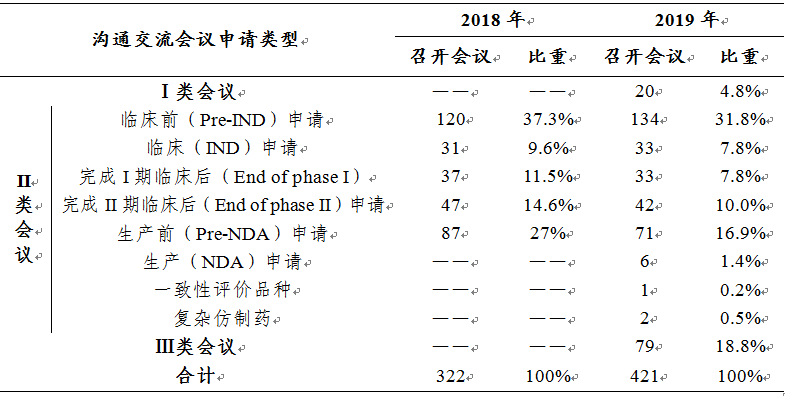
溝通交流會議的形式為電話會議����、視頻會議、面對面會議�。2019年召開了溝通交流會議421次,較2018年(322次)增長30.7%�。2018-2019年各類溝通交流會議的召開情況詳見表7。
3.一般性技術問題答復情況
在藥審中心網(wǎng)站上接收了社會公眾16572個一般性技術問題的咨詢��?��?傮w上���,按照內(nèi)容分類,公眾咨詢的問題主要集中于原輔包(4152個)����、受理(1846個)等方面;按照藥品分類��,公眾咨詢的問題主要集中于化學藥物(9743個),并且集中于化學藥一致性評價(1386個)���、化學藥受理(1174個)等方面�。一般性技術問題答復具體情況詳見表8���。
表8 一般性技術問題答復具體情況
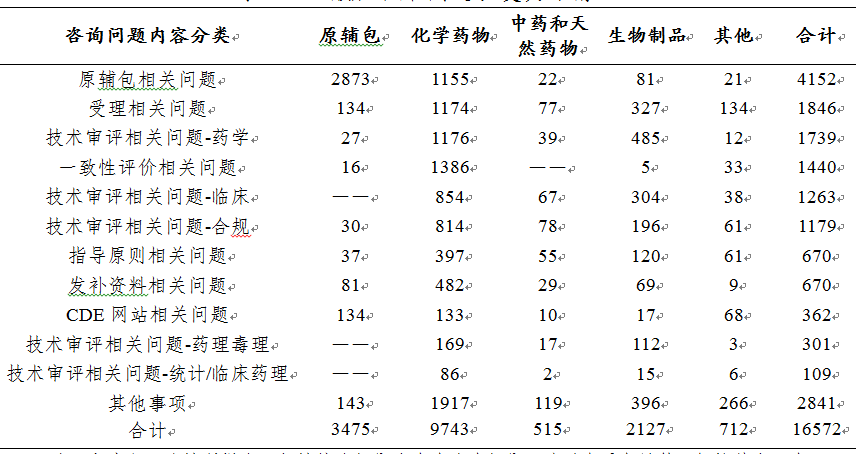
注:申請人一次性所提出一般性技術問題中含有多個問題���,為避免重復計算�����,僅按其中一個問題的類型進行統(tǒng)計。
?。ò耍┖瞬闄z查情況
2019年,藥審中心基于技術審評需要和申請人合規(guī)情況�,啟動核查任務1230個��,其中藥學現(xiàn)場核查任務782個�,臨床試驗數(shù)據(jù)核查任務446個����,藥理毒理研究核查任務2個。
2019年����,藥審中心接收核查報告1242份,其中藥學現(xiàn)場檢查報告689份�����,臨床試驗核查報告551份���,藥理毒理研究核查報告2個����。
此外���,基于投訴舉報和審評發(fā)現(xiàn)的問題��,2019年藥審中心啟動有因檢查12個��,接收有因檢查報告8份���。
三���、重點治療領域品種
抗腫瘤藥物:
1.甲磺酸氟馬替尼片,為我國首個具有自主知識產(chǎn)權的小分子Bcr-abl酪氨酸激酶抑制劑�,適用于治療費城染色體陽性的慢性髓性白血病慢性期成人患者,本品獲批上市為此類患者提供了更好的治療選擇�。
2.達可替尼片,為第二代小分子表皮生長因子受體(EGFR)酪氨酸激酶抑制劑(TKI)�,適用于局部晚期或轉移性表皮生長因子受體敏感突變的非小細胞肺癌患者的一線治療。與第一代EGFR-TKI相比�,本品可延長患者的生存期,為此類患者提供了更好的治療手段�����。
3.甲苯磺酸尼拉帕利膠囊�,為一種高選擇性的多聚腺苷5'二磷酸核糖聚合酶(PARP)抑制劑創(chuàng)新藥物,適用于鉑敏感的復發(fā)性上皮性卵巢癌����、輸卵管癌或原發(fā)性腹膜癌成人患者在含鉑化療達到完全緩解或部分緩解后的維持治療��,本品獲批上市為此類患者提供了新的治療選擇。
4.地舒單抗注射液�����,為核因子κB受體激活因子配體(RANKL)的全人化單克隆IgG2抗體�����,適用于治療不可手術切除或者手術切除可能導致嚴重功能障礙的骨巨細胞瘤�����,屬臨床急需境外新藥名單品種�����。本品獲批上市填補了此類患者的治療空白���,滿足其迫切的臨床需求��。
5.達雷妥尤單抗注射液����,為全球首個抗CD38單克隆抗體,也是用于治療多發(fā)性骨髓瘤的首個單克隆抗體�,適用于治療既往經(jīng)過蛋白酶體抑制劑和免疫調(diào)節(jié)劑治療后無藥可選的多發(fā)性骨髓瘤,本品獲批上市為此類患者帶來了治療獲益�。
6.利妥昔單抗注射液,為國內(nèi)首個利妥昔單抗生物類似藥注射液�����,同時也是國內(nèi)首個上市的生物類似藥���,適用于治療非霍奇金淋巴瘤�����,本品獲批上市提高了此類患者的臨床可及性��。
7.貝伐珠單抗注射液��,為國內(nèi)首個貝伐珠單抗注射液生物類似藥�����,適用于治療轉移性結直腸癌�����,晚期�、轉移性或復發(fā)性非小細胞肺癌,本品獲批上市將提高該類藥品的可及性�����。
抗感染藥物:
8.格卡瑞韋哌侖他韋片�����,為全新的抗丙肝固定組合復方制劑�,適用于治療基因1����、2、3�����、4�����、5或6型慢性丙型肝炎病毒(HCV)感染的無肝硬化或代償期肝硬化成人和12歲至18歲以下青少年患者��,屬臨床急需境外新藥名單品種。本品針對全基因型在初治無肝硬化患者中的治療周期可縮短至8周�,其獲批上市將進一步滿足臨床需求,為丙肝患者提供了更多治療選擇���。
9.索磷韋伏片�����,為索磷布韋�、維帕他韋��、伏西瑞韋3種成分組成的固定復方制劑�����,適用于治療慢性丙型肝炎病毒感染�,屬臨床急需境外新藥名單品種。本品可為全基因型既往直接抗病毒藥物(DAA)治療失敗的丙肝患者提供高效且耐受的補救治療方案�,填補了臨床空白。
10.拉米夫定替諾福韋片�����,為拉米夫定和替諾福韋二吡呋酯的固定劑量復方制劑��,適用于治療人類免疫缺陷病毒-1(HIV-1)感染,屬國內(nèi)首個仿制藥��。拉米夫定片和替諾福韋二吡呋酯片的聯(lián)合治療方案為臨床抗HIV的一線治療方案���,本品獲批上市可提高患者的用藥依從性��。
11.注射用頭孢他啶阿維巴坦鈉�,為新型β-內(nèi)酰胺酶抑制劑�����,適用于治療復雜性腹腔內(nèi)感染��、醫(yī)院獲得性肺炎和呼吸機相關性肺炎��、以及在治療方案選擇有限的成人患者中治療由革蘭陰性菌引起的感染�。本品獲批上市可解決日益突出的耐藥菌感染所帶來的巨大挑戰(zhàn)���,滿足了迫切的臨床治療要求�����。
循環(huán)系統(tǒng)藥物:
12.波生坦分散片���,為我國首個用于兒童肺動脈高壓(PAH)的特異性治療藥物���,屬兒童用藥且臨床急需境外新藥名單品種。PAH是一種進展性的危及生命的疾病��,國內(nèi)尚無針對兒童PAH患者的特異性治療藥物�,本品為針對兒童開發(fā)的新劑型,其獲批上市解決了兒童PAH患者的用藥可及性�。
風濕性疾病及免疫藥物:
13.注射用貝利尤單抗,為一種重組的完全人源化IgG2λ單克隆抗體���,適用于在常規(guī)治療基礎上仍具有高疾病活動的活動性����、自身抗體陽性的系統(tǒng)性紅斑狼瘡(SLE)成年患者��,是全球近60年來首個上市用于治療SLE的新藥�。目前SLE治療選擇不多,本品獲批上市滿足了SLE患者未被滿足的臨床需求��。
14.阿達木單抗注射液��,為國內(nèi)首個阿達木單抗生物類似藥��,適用于治療成年患者的類風濕關節(jié)炎、強直性脊柱炎和銀屑病等自身免疫性疾病�,本品獲批上市將提高該類藥物的臨床可及性,有效降低患者經(jīng)濟負擔�。
神經(jīng)系統(tǒng)藥物:
15.拉考沙胺片,為新型抗癲癇藥物�����,適用于16歲及以上癲癇患者部分性發(fā)作的聯(lián)合治療��,屬國內(nèi)首個仿制藥�����,本品獲批上市提高了此類患者的用藥可及性��,方便患者使用��。
16.咪達唑侖口頰粘膜溶液�����,為國內(nèi)首家治療兒童驚厥急性發(fā)作的口頰粘膜溶液�����,屬兒童用藥�����。小兒驚厥常為突然發(fā)作���,靜脈注射�����、肌肉注射�、直腸給藥等給藥方式較為困難����,口頰粘膜給藥方式可彌補上述給藥途徑的不足,本品獲批上市為此類患者提供了一項新的更便捷的給藥方式����。
鎮(zhèn)痛藥及麻醉科藥物:
17.水合氯醛灌腸劑,適用于兒童檢查/操作前的鎮(zhèn)靜�、催眠,以及監(jiān)護條件下的抗驚厥的中樞鎮(zhèn)靜藥物�,屬首批鼓勵研發(fā)申報兒童藥品清單品種。本品是適合兒童應用的劑型,其獲批上市填補了國內(nèi)兒童診療鎮(zhèn)靜用水合氯醛制劑無上市品種的空白�����,滿足我國兒科臨床迫切需求�。
皮膚及五官科藥物:
18.本維莫德乳膏,為具有我國自主知識產(chǎn)權的全球首創(chuàng)治療銀屑病藥物���,具有全新結構和全新作用機制��,適用于局部治療成人輕至中度穩(wěn)定性尋常型銀屑病�����。本品獲批上市為臨床提供了一種新型的安全有效治療藥物選擇���。
19.司庫奇尤單抗注射液,為我國首個白介素類治療中至重度銀屑病藥物��,屬臨床急需境外新藥名單品種��。與TNFα類藥物相比�,本品療效更好�����,其獲批上市為此類患者提供了一種新作用機制的藥物選擇。
罕見病藥物:
20.依洛硫酸酯酶α注射液����,為國內(nèi)首個且唯一用于治療罕見病IVA型黏多糖貯積癥(MPS IVA,Morquio A綜合征)的酶替代治療藥物�,屬臨床急需境外新藥名單品種。黏多糖貯積癥是是嚴重危及生命且國內(nèi)尚無有效治療手段的疾病��,本品獲批上市填補了我國此類患者的用藥空白����。
21.注射用阿加糖酶β,為治療罕見病法布雷病的長期酶替代療法藥物����,屬臨床急需境外新藥名單品種。法布雷病是嚴重危及生命且國內(nèi)尚無有效治療手段的疾病����,已列入我國第一批罕見病目錄,本品獲批上市填補了國內(nèi)此類患者的治療空白����。
22.諾西那生鈉注射液����,為國內(nèi)首個且唯一用于治療罕見病脊髓性肌萎縮癥的藥物��,屬臨床急需境外新藥名單品種����。本品有效解決了我國脊髓性肌萎縮癥目前尚無有效治療手段的臨床用藥急需。
23.依達拉奉氯化鈉注射液��,適用于治療罕見病肌萎縮側索硬化(ALS)����,屬臨床急需境外新藥名單品種。本品有效解決了目前我國ALS尚無有效治療手段的臨床用藥急需���。
預防用生物制品(疫苗):
24. 13價肺炎球菌多糖結合疫苗����,為具有自主知識產(chǎn)權的首個國產(chǎn)肺炎球菌結合疫苗��,適用于6周齡至5歲(6周歲生日前)嬰幼兒和兒童�,預防1型��、3型等13種血清型肺炎球菌引起的感染性疾病。本品是全球第二個預防嬰幼兒和兒童肺炎的疫苗�����,其上市提高了該類疫苗的可及性���,可更好的滿足公眾需求��。
25.重組帶狀皰疹(CHO細胞)疫苗�,適用于50歲及以上成人預防帶狀皰疹��,屬臨床急需境外新藥名單品種�����。隨著年齡增長���,帶狀皰疹患病風險升高���,且其并發(fā)癥嚴重影響患者正常工作和生活,目前國內(nèi)缺少對該疾病的有效預防和治療手段��,本品獲批上市進一步滿足了公眾特別是我國老齡患者的臨床用藥需求�。
26.雙價人乳頭瘤病毒疫苗(大腸桿菌)���,為首個國產(chǎn)人乳頭瘤病毒(HPV)疫苗,適用于9~45歲女性預防由HPV16/18引起的相關疾病���,9~14歲女性也可以選擇采用0���、6月分別接種1劑次的免疫程序。本品可進一步緩解國內(nèi)HPV疫苗的供需緊張��,有助于滿足我國女性對HPV疫苗的臨床需求�。
中藥新藥:
27.芍麻止痙顆粒,為白芍����、天麻等11種藥味組成的新中藥復方制劑,屬兒童用藥��,可治療抽動-穢語綜合征(Tourette綜合征)及慢性抽動障礙中醫(yī)辨證屬肝亢風動���、痰火內(nèi)擾者��。本品可明顯改善患兒的運動性抽動��、發(fā)聲性抽動��,以及社會功能缺損�,精神神經(jīng)系統(tǒng)不良反應發(fā)生率明顯低于已上市藥品之一的陽性藥鹽酸硫必利片��,為患兒尤其是輕中度患兒提供了一種更為安全有效的治療選擇���,滿足患者需求和解決臨床可及性��。
28.小兒荊杏止咳顆粒��,為荊芥���、苦杏仁等12種藥味組成的新中藥復方制劑,屬兒童用藥���,具有“疏風散寒���、宣肺清熱、祛痰止咳”的功效����,適用于治療小兒外感風寒化熱的輕度支氣管炎。本品在咳嗽�、咳痰等主要癥狀改善和中醫(yī)證候��、疾病愈顯率等方面具有明顯療效����,不良反應較少���,為急性支氣管炎小兒患者提供了一種新的安全有效的治療選擇�����。